化学检验员报告/证书管理程序
《化学检验员报告/证书管理程序》内容覆盖检测报告和校准证书(如适用)的编制、审核、批准、发放、修改、存档等全生命周期管理,符合 CNAS-CL01(ISO/IEC 17025:2017)、CMA(检验检测机构资质认定)及GMP/GLP等法规要求,兼具合规性与可操作性。
化学检验员报告/证书管理程序
一、目的
规范检测报告和校准证书(以下简称“报告”)的编制、审核、批准、发放、修改与存档流程,确保其准确性、完整性、合法性、可追溯性,维护实验室技术信誉与客户权益。
二、适用范围
适用于本实验室所有对外出具的检测报告、测试报告、分析证书、校准证书等正式技术文件。
注:内部流转单、原始记录、中间计算表等不属于本程序所指“报告”。
三、职责分工
| 角色 | 职责 |
|---|---|
| 检验员 | - 编制报告初稿 - 确保数据真实、完整、与原始记录一致 - 标注不确定度(如要求) - 提交审核 |
| 审核人(通常为技术主管或资深检验员) | - 审核方法适用性、数据逻辑性、结论合理性 - 检查格式规范性、信息完整性 - 对异常结果提出质询 |
| 授权签字人 | - 最终批准报告 - 对报告的技术内容和结论负法律责任 - 确保报告在认可范围内(如CNAS标识使用合规) |
| 文档管理员 | - 报告编号、盖章、发放、归档 - 维护报告台账 - 控制电子/纸质副本一致性 |
四、报告编制要求
(一)必备信息(依据 ISO/IEC 17025:2017 第7.8条)
每份报告必须包含以下内容:
唯一性标识(报告编号)
实验室名称和地址
客户信息(名称、地址、联系人)
样品信息
名称、编号、状态描述、接收日期
检测依据
标准方法编号及名称(如 GB/T 5009.12-2017)
非标方法需注明“经客户同意”
检测项目与结果
清晰列出项目、单位、数值、检出限(LOD)/定量限(LOQ)
超标结果建议加粗或标注“★”
测量不确定度(如客户要求或认可准则规定)
结论(如“符合XX标准要求”、“不合格”等,避免模糊表述)
检验员、审核人、批准人签名(手签或合规电子签名)
报告发布日期
声明
“本报告仅对来样负责”
“未经书面批准,不得部分复制”
CNAS认可标识使用声明(如适用)
✅ 禁止出现:
“大概”、“约”、“估计”等模糊用语
无依据的主观判断(如“质量良好”)
未授权使用CNAS/CMA标识
五、报告审批与签发流程
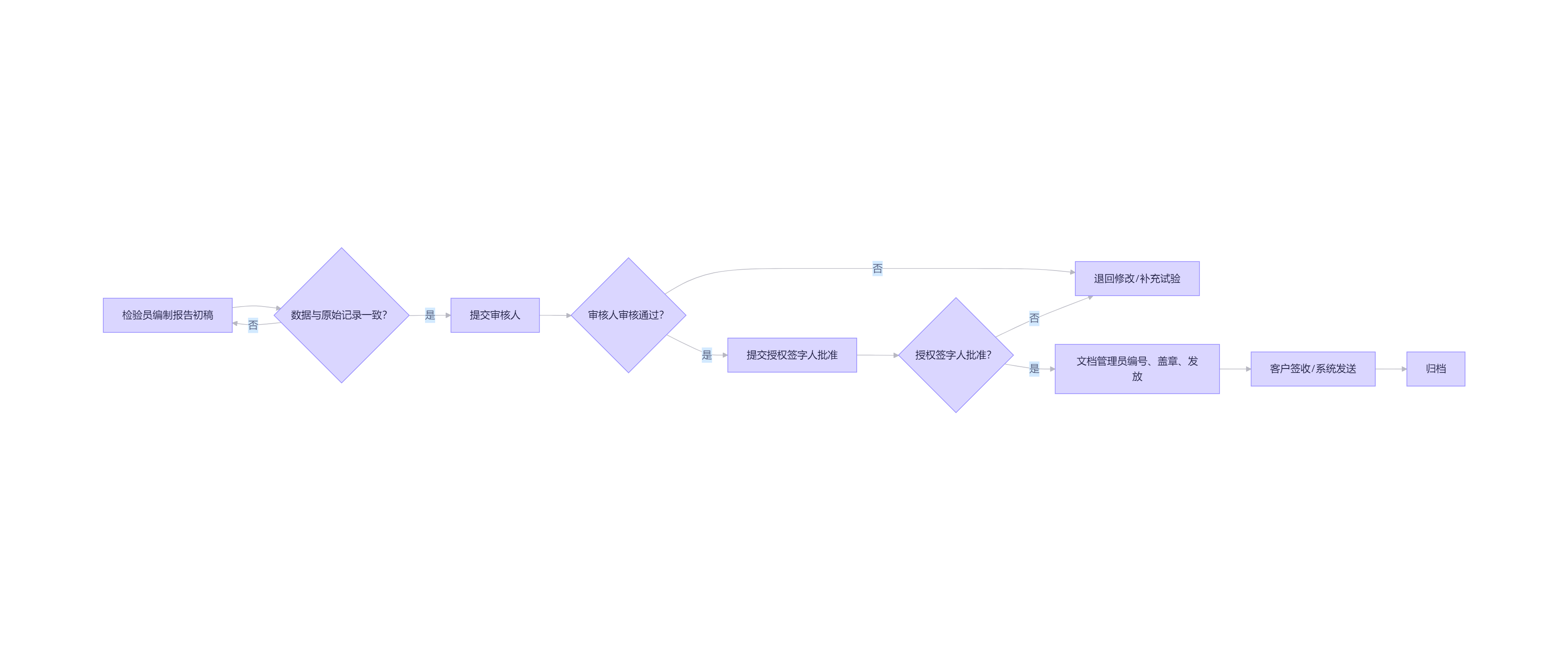
六、报告修改与更正
(一)修改情形
客户信息错误
打印/排版错误(非数据错误)
数据录入错误(需有原始记录支持)
(二)处理方式
| 错误类型 | 处理流程 |
|---|---|
| 发布前发现错误 | 直接在系统中修正,重新走审批流程 |
| 发布后发现非技术性错误(如客户名称拼写) | 出具《报告更正说明》,注明原报告编号、更正内容、原因,经授权签字人批准后发放 |
| 发布后发现技术性错误(如数据、结论错误) | 1. 立即通知客户停用原报告 2. 启动不符合工作控制程序 3. 重新检测或复核 4. 出具新版报告(新编号),原报告作废并标注“作废” |
⚠️ 严禁:
在已发出的纸质报告上手写修改;
用“勘误页”替代正式更正程序;
隐瞒错误不告知客户。
七、报告发放与传递
发放方式
纸质:客户签收,保留签收单;
电子:通过加密邮件、LIMS客户 portal 发送,保留发送日志。
副本控制
正本仅一份(或按客户要求份数);
实验室留存完整副本(含所有附件、图谱)。
保密要求
未经客户许可,不得向第三方透露报告内容;
电子传输需加密(如PDF密码、SSL通道)。
八、报告归档与保存
归档内容
最终版报告(PDF/纸质)
原始记录(关联编号)
审批流程记录(电子或纸质)
客户签收单或发送日志
如有更正,附《更正说明》或新版报告
保存期限
不少于6年(CNAS要求);
法规有更长期限的从其规定(如药品≥产品有效期+1年)。
存储方式
纸质:防火防潮档案柜,分类编号;
电子:服务器备份 + 异地备份,定期验证可读性。
九、CNAS/CMA标识使用规范(如适用)
仅限认可范围内的项目使用CNAS标识;
CMA标志仅用于资质认定范围内的报告;
标识下方必须标注实验室认可编号(如 CNAS LXXXX);
不得用于广告、宣传材料或非检测用途。
十、附则
本程序由质量负责人组织制定,技术负责人审核,最高管理者批准。
检验员、审核人、授权签字人每年须接受本程序培训。
本程序每年评审一次,或在认可准则更新时及时修订。
结语:
检测报告是实验室的“技术名片”,也是法律证据。
一字之差,可能引发客户损失、监管处罚甚至法律诉讼。
每一位参与报告编制、审核、签发的人员,都应以敬畏之心、专业之能、责任之肩对待每一份报告。





